Pharmastandort Deutschland –
Prioritäten richtig setzen.
Ein Beitrag Dr. Josef M. Hofer.
Der Forschungs- und Produktionsstandort Deutschland verliert im internationalen Vergleich kontinuierlich an Bedeutung. Früher war Deutschland die Apotheke der Welt, heute sind China und Indien die Apotheke der Welt. Meldungen, dass der Pharma- und Agrarkonzern Bayer den Schwerpunkt seines Pharmageschäfts in die USA und nach China verlagern will, lassen die Alarmglocken läuten. Vor allem dann, wenn man die Begründung von Bayer-Pharmachef Stefan Oelrich liest. „Europa ist innovationsunfreundlich und macht einige wirklich große Fehler”, sagte der Bayer-Pharmachef Mitte des Monats der “Financial Times” in einem Interview. „Wir verlagern unseren kommerziellen Fußabdruck und die Ressourcen für unseren kommerziellen Fußabdruck deutlich weg von Europa.” In den USA ließen sich höhere Preise für Medikamente erzielen, das wiederum mache es Firmen möglich, den Auftrieb der Kosten auszugleichen. Und China steht Innovationen zunehmend positiv gegenüber, das will der Konzern zukünftig stärker nutzen und seine Präsenz weiter ausbauen.
Europa verliert als Innovationsstandort im internationalen Wettbewerb an Boden und auch in Deutschland wird die Debatte über den Pharmastandort Deutschland immer lauter geführt, angeheizt von den Arzneimittelengpässen der letzten Wochen. Der FDP Gesundheitspolitiker Andrew Ullman forderte unlängst, dass die Bundesregierung eng mit der Industrie zusammenarbeiten müsse, um Rahmenbedingungen herzustellen, „damit die Ansiedlung in Deutschland wieder attraktiv wird. Es sei jahrelang an der falschen Stelle gespart worden, was die Entstehung monopolistischer Lieferketten zur Folge gehabt habe.”
Doch wie kann dies gelingen? Kann Deutschland seine einstige Spitzenposition als „Apotheke der Welt“ wieder zurückgewinnen? Ich denke ja, aber dafür müssen die Prioritäten richtig gesetzt werden.
Veränderte Regeln, neue Hürden
Ich bin davon überzeugt, dass das Problem “Standortwechsel” eine tiefergehende Wurzel als nur höhere Arbeitslöhne und Kosten in Deutschland bzw. Europa besitzt. Das Umfeld für pharmazeutische Innovationen und Märkte ist in Deutschland, vorsichtig ausgedrückt, bescheiden. Die Auswirkungen von kommerziellen Einschränkungen und bürokratischen Hürden sind für die Forschung und Entwicklung (F&E) von Arzneimitteln und Medizinprodukten allerdings erheblich und auch schon länger offensichtlich.
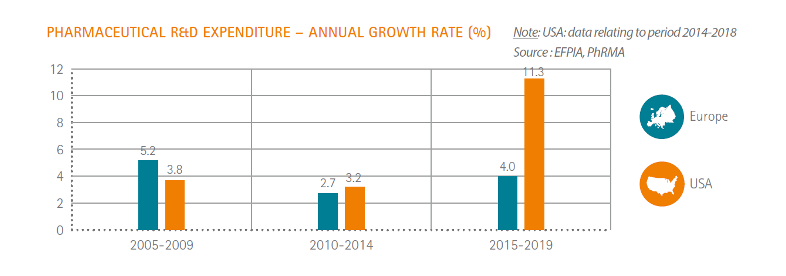
„Pharma ist die forschungsintensivste Industrie in Deutschland. Mit einem Anteil von durchschnittlich 17 Prozent am Umsatz und 21 Prozent der Beschäftigten bilden die Unternehmen in Deutschland die Speerspitze in Sachen Forschung und Entwicklung, schreibt die F.A.Z. und führt an, dass je Mitarbeiter die Pharmafirmen rund 38.600 Euro in die eigene Forschung investieren. Zahlen die vom Branchenverband VFA kommen. Im Automobilbau sind es 29.900 Euro je Kopf, im Maschinenbau nur 11.600 Euro. Auch in Europa sei der Standort Deutschland gut aufgestellt: So entfällt laut VFA rund ein Viertel der gesamteuropäischen Ausgaben für Pharmaforschung auf Unternehmen in Deutschland. Das klingt zunächst mal gut ist aber leider eher ein „Tropfen auf dem heißen Stein“. Deutlich wird das, wenn man sich die Grafik ansieht, die zeigt wie sich die Aufwendungen für F&E der pharmazeutischen Industrie entwickeln und vor allem wohin sie sich verteilen.
Im letzten Jahr haben, wie Pharma Fakten schreibt, die US-Pharmafirmen 102,3 Milliarden US-Dollar in die Forschung und Entwicklung neuer Arzneimittel und Impfstoffe investiert. In den vergangenen zwei Jahrzehnten sind es rund 1,1 Billionen Dollar gewesen. Zum Vergleich: In Europa investierte die pharmazeutische Industrie 2021 ca. 41 Milliarden Euro 2021 in die Forschung und Entwicklung.
Die “pharmazeutische Innovationskraft” kann auch an den Zahlen von “breakthrough” Arzneimittel und den damit verbundenen Patenten abgelesen werden. Zwischen 2010 und 2019 dominieren mit rund 55 % Anteil weltweit die US- Unternehmen, die deutschen liegen mit nur rund 9 % weit abgeschlagen. Für die dazugehörigen Basispatente ist der Vorsprung mit 62 % zu 7 % noch größer. Direkte Zahlen aus den Entwicklungsaufgaben wie z.B. die Durchführung von klinischen Prüfungen in Deutschland unterstreichen diesen Niedergang. Mit nur noch 589 Studien in 2020 liegen wir in Europa hinter Spanien (682) und weit nach den USA (2.747) und China (1.139) .
Trotz der hohen Investitionen in die pharmazeutische Forschung und Entwicklung (F&E) verliert Europa an Boden und droht im internationalen Vergleich abgehängt zu werden. So stiegen die Ausgaben für F&E in China zuletzt um jährlich 12,9 Prozent an, in den USA um 8,5 Prozent und in Europa um lediglich 4 Prozent (siehe auch Grafik).
Aus verschiedensten Berichten der OECD zeigt sich nicht nur ein Rückgang im prozentualen Anteil der Pharmabranche an der Industrieforschung gegenüber Forschungsstandorten wie USA, China, Indien, Singapur und Südkorea, auch die Dynamik der Aufwendungen von F&E nimmt ab. In 1973 erreichten die F&E-Aufwendungen der deutschen Pharmaindustrie noch einen Anteil von knapp 13 Prozent an denen der Branche, 2019 nur noch 5,7%. Dabei ist zu berücksichtigen, dass die Kosten für die Forschung und Entwicklung von neuen Arzneimittel massive Steigerungen erfahren haben, sodass derzeit mit Aufwendungen zwischen 0,8 und 2,3 Milliarden Euro zu kalkulieren ist.
Dies trifft nicht nur die Pharma-Riesen wie Bayer, Böhringer Ingelheim, Merck Darmstadt, nein mit Sicherheit und sogar noch stärker die mittelständischen deutschen Unternehmen, für die globale Ausweichpositionen viel schwerer zu erreichen sind. In diesem Zusammenhang dürfen die deutschen – ebenfalls meist mittelständische – Medizinproduktehersteller nicht vergessen werden, die aufgrund der massiven regulatorischen Herausforderungen mit der neuen europäischen Medizinprodukteverordnung , den außenwirtschaftlichen protektionistischen Tendenzen, aber auch den innerdeutschen Finanzierungssystemen von Krankenhäusern und Pflegeinrichtungen zu kämpfen haben.
Forschung und Produktion
Auf der Webseite des VCI (Verband der chemischen Industrie e.V.) findet sich dieser schöne Satz: „Dort, wo geforscht wird, wird auch produziert. Medikamente sind so schneller verfügbar.“ Seit einigen Jahren zeichnet sich aber eine negative Entwicklung ab: Im Wettbewerb fällt Deutschland immer weiter hinter Länder wie die USA, China und Großbritannien zurück. Klinische Forschung für Biotechproduktion, Gen- und Zelltherapien finden zunehmend dort statt, moniert der Verband.
Innovationen stärken
Wenn es also gelingt, die Innvovationskraft in Deutschland wieder attraktiv auszustatten – das Potential ist vorhanden – dann werden den F&E Erfolgen konsequenterweise wieder Produktionsaktivitäten folgen. Denn die Abhängigkeiten zwischen Forschung und Entwicklung und Herstellung von Arzneimitteln bzw. Medizinprodukten sind essentiell und existentiell. Für den Standort Deutschland spricht grundsätzlich unsere wissenschaftlich hervorragende Infrastruktur basierend auf den fachlich sehr guten Universitäten und Fakultäten, der großen Anzahl an außeruniversitären Forschungseinrichtungen wie Max-Planck-, Fraunhofer-Instituten, die Helmholtz-Zentren, sowie sich daraus rekrutierende, sehr gut ausgebildete und hochkompetente Mitarbeiter in den Behörden und den Unternehmen. Wenn es also gelingt, die Innvovationskraft in Deutschland wieder attraktiv auszustatten – das Potential ist vorhanden – dann werden den F&E Erfolgen konsequenterweise wieder Produktionsaktivitäten folgen. Denn die Abhängigkeiten zwischen Forschung und Entwicklung und Herstellung von Arzneimitteln bzw. Medizinprodukten sind essentiell und existentiell.
Handlungsbedarf
Damit der Standort Deutschland für die Pharmaindustrie wieder attraktiv wird, sehe ich bei diesen Punkten Handlungsbedarf:
Etablierung und Förderung von Forschungskooperationen, sowie Bündelung und Aufgabenaufteilung von Entwicklungsaktivitäten,
risikobasierte, nicht formal und bürokratisch überbordende Zulassungsverfahren für Arzneimittel, Medizinprodukte und die dafür erforderlichen klinischen Prüfungen,
Wiederverwendbarkeit von wissenschaftlichen Dokumentationen z.B. bei der Beantragung von neuen Indikationen für bestehende Arzneimittel (Repurposing ) zur Schaffung innovativer Therapiemöglichkeiten mit einer erheblichen Reduzierung des präklinischen und toxikologischen Untersuchungaufwands,
gezielte Forschungsförderung für Mittelständler und Start-ups als wichtige Innovationsträger,
effiziente Digitalisierung und die Anwendung von maschinellem Lernen als wichtige Hilfsmittel, die die Verfahren beschleunigen können. Gegenseitige Anerkennung von Zulassungsentscheidungen zur Einsparung von Ressourcen.
Für mich steht fest: Innovation wird gefördert durch mehr Freiraum, Stärkung und Akzeptanz der Eigenverantwortung, Reduzierung von formalen, redundanten Prozessen, sowohl in den Unternehmen als auch in den Überwachungs- und Zulassungsbehörden.
Titelbild von National Cancer Institute auf Unsplash
Dr. Josef M. Hofer
Dr. Hofer ist seit vielen Jahren in und für die Pharmaindustrie bei der Forschung und Entwicklung von Arzneimitteln und Medizinprodukten weltweit tätig. Aufgrund seiner Schwerpunktdisziplin “Regulatory Affairs” ist er in der Lage den gesamten Wertschöpfungsprozess – von der Idee bis zum Patienten – zu überblicken und zu bewerten. Dr. Hofer ist Geschäftsführer der exdra GmbH.
Sein Grundsatz lautet „Think the end in mind“
E-Mail: dr.j.hofer@exdra-gmbh.de

